医薬品情報
| 総称名 | ユーパスタ |
|---|---|
| 一般名 | 精製白糖 ポビドンヨード |
| 欧文一般名 | Sucrose Povidone-Iodine |
| 製剤名 | 精製白糖・ポビドンヨード配合軟膏 |
| 薬効分類名 | 褥瘡・皮膚潰瘍治療剤 |
| 薬効分類番号 | 2699 |
| KEGG DRUG |
D04812
精製白糖・ポビドンヨード
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年4月 改訂(第2版)

|
2.禁忌 4.効能または効果 5.効能又は効果に関連する注意 6.用法及び用量 9.特定の背景を有する患者に関する注意 11.副作用 14.適用上の注意 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ユーパスタ軟膏 | U-PASTA Ointment | テイカ製薬 | 2699801V1165 | 12.4円/g |
2. 禁忌
次の患者には投与しないこと
本剤の成分又はヨウ素に対し過敏症の既往歴のある患者
4. 効能または効果
褥瘡、皮膚潰瘍(熱傷潰瘍、下腿潰瘍)
5. 効能または効果に関連する注意
5.1 本剤による治療は保存的治療であることに留意し、症状の改善傾向が認められない場合は外科的療法等を考慮すること。
5.2 熱傷潰瘍に本剤を使用する場合、本剤の対象は熱傷後の二次損傷により生じた熱傷潰瘍であるので、新鮮熱傷に対しては他の適切な療法を考慮すること。
6. 用法及び用量
症状及び病巣の広さに応じて適量を使用する。
潰瘍面を清拭後、1日1〜2回ガーゼにのばして貼付するか、又は患部に直接塗布しその上をガーゼで保護する。
潰瘍面を清拭後、1日1〜2回ガーゼにのばして貼付するか、又は患部に直接塗布しその上をガーゼで保護する。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 甲状腺機能に異常のある患者
ポビドンヨード投与により血中ヨウ素値の調節ができず、甲状腺ホルモン関連物質に影響を与える可能性がある。
9.2 腎機能障害患者
9.2.1 腎不全のある患者
ポビドンヨード投与により血清中総ヨウ素濃度が著しく高くなることが報告されている。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ使用すること。長期にわたる広範囲の使用は避けること1)。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。長期にわたる広範囲の使用は避けること1)。
9.7 小児等
新生児にポビドンヨードを使用し、甲状腺機能低下症を起こしたとの報告がある2)。
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には使用を中止するなど適切な処置を行うこと。
11.1.1 ショック、アナフィラキシー(いずれも頻度不明)
呼吸困難、不快感、浮腫、潮紅、じん麻疹等があらわれることがある。
注1)発現頻度は使用成績調査を含む。
11.2 その他の副作用
| 0.1〜5%未満 | 頻度不明 | |
| 過敏症 | ヨード疹注2) | |
| 皮膚注3) | 疼痛、発赤、刺激感、皮膚炎、そう痒感 | |
| 甲状腺 | 血中甲状腺ホルモン値(T3、T4値等)の上昇あるいは低下などの甲状腺機能異常注2) |
14. 適用上の注意
14.1 薬剤投与時の注意
14.1.1 眼科用に使用しないこと。
14.1.2 他剤と混合して使用しないこと。
14.1.3 患部の清拭消毒を行うこと。
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 膣内にポビドンヨードを使用し、血中無機ヨウ素値及び血中総ヨウ素値が上昇したとの報告がある3)。
15.1.2 本剤はヨウ素含有製剤であるので、大量使用及び長期連用時には甲状腺機能の変動に注意すること。
16. 薬物動態
16.1 血中濃度
16.1.1 白糖
(1)単回塗布
14Cで標識した白糖を用いて調製した本剤100mgをラット皮膚欠損創に4時間及び損傷皮膚に24時間単回塗布(各4匹)したとき、それぞれ塗布後1時間以内に最高血中濃度53及び105μg eq./mLに達し、以後速やかに減少した4)。
16.1.2 ヨウ素
16.2 吸収
16.2.1 白糖
14Cで標識した白糖を用いて調製した本剤100mgをラット皮膚欠損創及び損傷皮膚に単回塗布したとき、白糖は速やかに経皮吸収され、その吸収は皮膚欠損創よりも損傷皮膚の方が大きかった4)。
16.2.2 ヨウ素
16.3 分布
16.3.1 ヨウ素
16.5 排泄
17. 臨床成績
17.1 有効性及び安全性に関する試験
<褥瘡>
17.1.1 国内臨床試験
<皮膚潰瘍>
18. 薬効薬理
18.1 作用機序
本剤に含まれるポビドンヨードは殺菌作用を有している。また、本剤に含まれる白糖の創傷治癒作用は、局所的浸透圧の上昇による浮腫軽減及び線維芽細胞の活性化に基づくと考えられている19)。
18.2 創傷治癒作用
18.2.1 本剤をラット欠損創及び皮膚潰瘍モデルに塗布した結果、肉芽新生及び表皮再生促進とともに治癒日数の短縮を、また糖尿病マウスの欠損創において肉芽組織及び血管数の増加を認めた20)21)22)。
18.2.2 本剤をラット切創モデルに塗布した結果、創耐張力の増加を認めた23)。
18.2.3 白糖の創傷治癒過程に対する影響
18.3 殺菌作用
19. 有効成分に関する理化学的知見
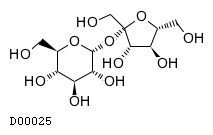
19.1. 精製白糖
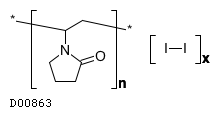
19.2. ポビドンヨード
20. 取扱い上の注意
20.1 直射日光又は高温を避けて保存すること。
20.2 開封後は乾燥を防ぐため密栓して保存すること。
22. 包装
プラスチック容器
100g、500g
チューブ
30g×10、100g、100g×10
23. 主要文献
- Danziger Y,et al., Arch Dis Child., 62, 295-296, (1987) »PubMed
- Jackson HJ,et al., Lancet., (8253), 992, (1981) »PubMed
- Vorherr H,et al., JAMA., 244, 2628-2629, (1980) »PubMed
- 甲重雄他, 薬理と治療, 17 (Suppl.1), 21-30, (1989)
- 阿部晴康他, 薬理と治療, 17 (Suppl.1), 31-42, (1989)
- 阿部晴康他, 薬理と治療, 19, 3855-3862, (1991)
- 今村貞夫他, 薬理と治療, 17 (Suppl.1), 255-280, (1989)
- KT-136皮膚潰瘍比較試験研究班, 薬理と治療, 17, 1789-1813, (1989)
- 今村貞夫他, 薬理と治療, 17 (Suppl.1), 119-132, (1989)
- KT-136皮膚潰瘍研究班, 薬理と治療, 17 (Suppl.1), 133-146, (1989)
- 大谷清他, 薬理と治療, 17 (Suppl.1), 147-156, (1989)
- 松井千尋他, 薬理と治療, 17 (Suppl.1), 157-175, (1989)
- 青山久他, 薬理と治療, 17 (Suppl.1), 177-190, (1989)
- 平本力他, 薬理と治療, 17 (Suppl.1), 191-206, (1989)
- 海塚安郎他, 薬理と治療, 17 (Suppl.1), 207-228, (1989)
- 古田勝経他, 薬理と治療, 17 (Suppl.1), 229-236, (1989)
- 荒金兆典他, 皮膚, 31, 102-108, (1989) »DOI
- KT-136関西地区研究班, 薬理と治療, 17 (Suppl.1), 237-254, (1989)
- 江藤義則他, 薬理と治療, 19, 3843-3850, (1991)
- 江藤義則他, 薬理と治療, 17 (Suppl.1), 7-14, (1989)
- 江藤義則他, 薬理と治療, 19, 3835-3841, (1991)
- 石重明他, 日本皮膚科学会雑誌, 106, 403-408, (1996) »DOI
- 江藤義則他, 皮膚科紀要, 82, 355-357, (1987)
- 秋葉知英他, 西日本皮膚科, 50, 1060-1068, (1988) »DOI
- 武内英二他, 皮膚科紀要, 82, 359-363, (1987)
- 朝田康夫他, 薬理と治療, 19, 3851-3854, (1991)
- 古志朋之他, 薬理と治療, 17 (Suppl.1), 15-20, (1989)
24. 文献請求先及び問い合わせ先
文献請求先
テイカ製薬株式会社
学術グループ
〒930-0982
富山市荒川一丁目3番27号
電話:076-431-1717
FAX:076-431-6707
製品情報問い合わせ先
テイカ製薬株式会社
学術グループ
〒930-0982
富山市荒川一丁目3番27号
電話:076-431-1717
FAX:076-431-6707
26. 製造販売業者等
26.1 製造販売元
テイカ製薬株式会社
富山市荒川一丁目3番27号